Máme osteoporózu pod kontrolou?
Souhrn: Osteoporóza (OP) je v současné době jedním z nejvýznamnějších chronických onemocnění pohybového aparátu. Je charakterizována úbytkem kostní hmoty a zvýšeným rizikem fraktur. Patofyziologie osteoporózy je komplexní a zahrnuje nerovnováhu mezi resorpcí a novotvorbou kosti, přičemž klíčovou roli hraje genetika, hormonální změny související s menopauzou či andropauzou, chronická onemocnění, dlouhodobě podávaná léčiva a vlivy životního stylu. Jako onemocnění s dlouhým latentním průběhem zůstává často nediagnostikovaná až do okamžiku OP zlomeniny, jež bývá spojena s významným nárůstem morbidity a mortality. Vzhledem k postupně stárnoucí populaci a rostoucí incidenci OP fraktur nabývá problematika prevence, diagnostiky a adekvátní léčby stále většího významu.
Současné terapeutické přístupy zahrnují jak farmakologické intervence zaměřené na zpomalení kostní resorpce či stimulaci novotvorby, tak i nefarmakologická opatření zahrnující úpravu životního stylu, dietní doporučení a přiměřenou pohybovou aktivitu. V posledních letech se rozšiřují možnosti cílené léčby ovlivňující konkrétní molekulární mechanismy kostního metabolismu, což přináší nové perspektivy v individualizované terapii.
Klíčová slova: osteoporóza, skóre FRAX, sekvenční terapie, osteoanabolická terapie, teriparatid)
Definice osteoporózy vytvořená Světovou zdravotnickou organizací (WHO) v roce 1994 ji popisuje jako „progresivní systémové onemocnění kostí charakterizované nízkou kostní hmotou a mikroarchitektonickým poškozením kostní tkáně s následným zvýšením křehkosti kosti a náchylnosti ke zlomeninám". Diagnóza osteoporózy je definována také denzitometricky, a to hodnotou BMD (kostní minerálová hustota). Za osteoporózu se považuje hodnota T-skóre menší než 2,5násobek záporné směrodatné odchylky (SD) průměru mladých dospělých (T-skóre menší nebo rovné −2,5 SD) za předpokladu vyloučení jiných příčin snížené kostní denzity [1] Anis JA, Melton LJ, Christiansen C, et al. The diagnosis of osteoporosis. J Bone Miner Res 1994;9(8):1137–41. .
Z pohledu příčiny vzniku onemocnění je osteoporóza dělena na primární a sekundární. Hlavní příčinou primární osteoporózy bývají změny související s věkem a hormonálními změnami v menopauze či andropauze; diagnóza primární osteoporózy je diagnózou per exclusionem. Sekundární osteoporóza se rozvíjí v důsledku jiného základního onemocnění nebo při užívání rizikové medikace. Pro vyloučení sekundární příčiny jsou potřebná laboratorní vyšetření i zobrazovací metody; diagnostika je založena na přítomnosti specifických rizikových faktorů, komorbiditách či klinicky relevantních skutečnostech. Vyšší riziko sekundární OP je v případě současného onemocnění s prokázaným negativním dopadem na kostní metabolismus, případně u osteoporózy zjištěné pod 50. rokem věku.
Ve věku 50 let má každá druhá žena (46 %) a každý pátý muž (22 %) zvýšené riziko, že prodělá některou z OP zlomenin [2] Svedbom A, et al. Osteoporosis in the European Union: a compendium of country-specific reports. Arch Osteoporos 2013;8(1):137. . Mezinárodní nadace pro osteoporózu (IOF) vydala v roce 2022 dodatek ke studii SCOPE z roku 2021 (kde byla souhrnná data pro země EU, Velkou Británii a Švýcarsko) pro jednotlivé státy. Podle výsledků této studie byla v roce 2019 v celkové populaci České republiky prevalence osteoporózy 5,0 %, což reprezentovalo asi 572 000 osob s osteoporózou, z toho 80 % tvořily ženy [3] Kanis JA, Norton N, Harvey NC, et al. SCOPE 2021: a new scorecard for osteoporosis in Europe. Arch Osteoporos 2021;16(1):82. . Podle dat z Národního registru hospitalizovaných pacientů za roky 2008 až 2016 bylo v České republice hospitalizováno zhruba 14 000 pacientů se zlomeninou proximálního femuru, z toho 68 % tvořily ženy. Roční přežití dosahovalo necelých 70 % [4] Němec P, Bučková B, Hejduk K, et al. Sekundární prevence osteoporotických zlomenin u stárnoucí populace mužů a žen v České republice. Gynekol Porod 2019;3(1):15–20. .
Patofyziologie
Fyziologicky je kost živá tkáň, která se neustále obměňuje díky rovnováze mezi činností osteoklastů (resorpce kosti) a osteoblastů (novotvorba kosti). Při osteoporóze je tato homeostáza narušena ve prospěch zvýšené resorpce či snížené novotvorby. Remodelace kosti je řízena hormony, cytokiny a signálními drahami. Při nedostatku estrogenů dochází ke zvýšené expresi RANKL a snížené produkci osteoprotegerinu, což stimuluje osteoklasty k vyšší aktivitě. Estrogeny normálně tlumí apoptózu osteoblastů a osteocytů, jejich absence tudíž snižuje i novotvorbu. Výsledkem je rychlejší úbytek kostní hmoty než její tvorba. V mužském organismu hraje podobně důležitou roli testosteron, který je částečně aromatizován na estrogen.
Významnou roli hrají také hormony regulující metabolismus vápníku, při sníženém příjmu či vstřebávání vápníku dochází k sekundární hyperparatyreóze. Zvýšený parathormon stimuluje resorpci kosti, aby udržel hladinu vápníku v séru. Nedostatek vitaminu D pak zhoršuje mineralizaci kosti a zvyšuje riziko osteomalacie souběžně s osteoporózou.
Diagnostika
V České republice probíhá od roku 2023 screeningový program časného záchytu osteoporózy. V rámci preventivní prohlídky u všeobecného praktického lékaře nebo u gynekologa bývá indikován u žen nad 60 let a u mužů nad 70 let. U žen rok po menopauze až do věku 59 let a u mužů ve věku 65 až 69 let se pro kalkulaci rizika zlomenin používá index FRAX. Index FRAX je standardizovaný dotazník, který umožňuje určit míru rizika vzniku osteoporotické zlomeniny (kyčle nebo jiné velké OP fraktury – páteř, předloktí, rameno) v následujících 10 letech (www.fraxplus.org/calculation-tool/ – viz též přiložený QR kód).

Algoritmus FRAX kombinuje klinické rizikové faktory. Podle hodnoty rizika je podle věkových skupin indikováno denzitometrické vyšetření. Kromě pacientů zachycených screeningovým programem jsou k denzitometrickému vyšetření indikováni pacienti s podezřením na sekundární osteoporózu nebo po prodělané nízkotraumatické zlomenině a pacienti s významnými rizikovými faktory.
Denzitometrické vyšetření je neinvazivní radiografická metoda, jež využívá dvoufotonové rentgenové absorpciometrie (dual-energy X-ray absorptiometry, DXA) k určení hustoty a mineralizace kostní tkáně. Využívá slabé rentgenové záření o dvou různých energiích – záření je jinak absorbováno kostní tkání a jinak měkkými tkáněmi (Obr. 1). Nutné je zdůraznit, že měření v bederní páteři může být zkresleno degenerativními změnami.
V diagnostice osteoporózy mají své nezastupitelné místo také laboratorní testy. Ty zahrnují stanovení základních parametrů kostního metabolismu, jako jsou vápník, fosfor, vitamin D a jeho metabolity, markery novotvorby kostí, jako jsou propeptidy prokolagenu typu I (PINP) a kostní izoenzymy alkalické fosfatázy (ALP), či ukazatele resorpce, C-terminálního telopeptidu kolagenu (betaCTX) a další laboratorní testy k vyloučení nejčastějších sekundárních příčin osteoporózy. Diagnóza primární osteoporózy je diagnózou per exclusionem. Při podezření na sekundární příčinu je nutno pátrat po specifických klinických příznacích a rizikových faktorech.
Mezi příčiny sekundární osteoporózy patří metabolická onemocnění (diabetes mellitus 2. typu), endokrinní onemocnění (diabetes mellitus 1. typu, hypertyreóza, hyperparatyreóza, Cushingův syndrom, hypogonadismus), onemocnění trávicího traktu a poruchy vstřebávání, chronická onemocnění jater nebo ledvin, onkologická onemocnění, genetické poruchy a choroby spojené s chronickým zánětem (revmatoidní artritida, axiální spondyloartritida, systémový lupus erythematodes, chronická obstrukční plicní nemoc, roztroušená skleróza, idiopatické střevní záněty). Mezi nejčastější formy sekundárních osteopatií pak patří léky indukovaná OP (glukokortikoidy, antiestrogenní terapie, androgen deprivační terapie).
Glukokortikoidy indukovaná osteoporóza (GIOP) se rozvíjí přibližně u 30–50 % nemocných, kteří užívají glukokortikoidy po dobu delší než 6 měsíců. Riziko fraktur je přitom závislé jak na výši denní dávky, tak na dávce kumulativní: u dávek odpovídajících 2,5–7,5 mg prednisonu se pravděpodobnost vzniku zlomeniny obratle zvyšuje přibližně 2,6násobně, zatímco při dávkách nad 7,5 mg prednisonu denně stoupá riziko fraktury obratle až 5,2násobně a riziko zlomeniny krčku femuru přibližně 2,3násobně [5] van Staa TP, Leufkens HG, Abenhaim L, et al. Use of oral corticosteroids and risk of fractures. J Bone Miner Res 2000;15:993–1000. .
Zobrazovací metody (skiagrafie, výpočetní tomografie, magnetická rezonance, pozitronová emisní tomografie) slouží k identifikaci ložiskových či osteolytických lézí, kromě pátrání po příčině jsou využívány také k diferenciální diagnostice k odlišení jiných onemocnění kosti.

Obr. 1 – Osteoporóza na denzitometrii. [Foto: Archiv autorky]
Riziko osteoporotické zlomeniny
U každé zlomeniny po minimálním traumatu je třeba zvažovat přítomnost nejen osteoporózy, ale také dalších příčin zvýšené kostní lomivosti. Zvláštní význam pro refrakterní frakturu má recentní OP zlomenina (do 2 let od vzniku), která představuje silný prediktor opakovaných fraktur v horizontu následujících 1–2 let [6] Barron RL, Oster G, Grauer A, et al. Determinants of imminent fracture risk in postmenopausal women with osteoporosis. Osteoporos Int 2020;31(11): 2103–10. . Rizikovm faktorem pro vznik jak vertebrálních, tak i nevrtebrálních fraktur, včetně fraktur kyčlí, je také počet a závažnost již přítomných obratllových zlomenin [7] Delmas PD, Genant HK, Crans JL, et al. Severity of prevalent vertebral fractures and the risk of subsequent vertebral and nonvertebral fractures: results from the MORE trial. Bone 2003;33(4):522–32. .
Prevence osteoporózy
Prevence osteoporózy vyžaduje aktivní spolupráci zdravotníků, společnosti a zdravotních pojišťoven vedoucí k edukaci a aktivnímu zájmu pacientů o vlastní zdraví.
Základem primární prevence osteoporózy je dosažení a udržení maximální kostní hmoty. To vyžaduje zdravý životní styl, pravidelnou pohybovou aktivitu a omezení rizikových faktorů, včetně kouření či konzumace alkoholu. Správná nutriční podpora od dětství až po seniorský věk je zásadní pro dosažení maximální vrcholové kostní hmoty (peak bone mass, PBM) i pro prevenci následných kostních ztrát. Optimální dieta při prevenci i léčbě osteoporózy zahrnuje dostatečný energetický příjem, dostatek proteinů, stopových prvků, vápníku a vitaminu D.
Vápník se nachází především v mléčných výrobcích, v listové zelenině a některých minerálních vodách a ořeších. Metabolismus vápníku je regulován jeho vstřebáváním z tenkého střeva, vychytáváním v ledvinách a kostním obratem. Toto je regulováno parathormonem, vitaminem D a množstvím volného vápníku. Poruchy v metabolismu vápníku se projeví nejen narušením kostní hmoty, aber i regulačními funkcemi na molekulární úrovni, v nervovém přenosu a svalové kontrakci [8] Vápník. Národní zdravotnický informační portál. Dostupné z: https://www.nzip.cz/clanek/1146-vapnik [cit. 2025 10 10]. .
Vitamin D je přítomen zejména v tučných rybách, másle nebo vaječném žloutku, lidský organismus ho syntetizuje v kůži vlivem ultrafialového záření. Aktivní vitamin D hraje důležitou úlohu v regulaci hladin vápníku a fosforu ovlivněním jejich vstřebávání ze střeva. Vitamin D zároveň ovlivňuje růst a diferenciaci buněk, především hematopoetických kmenových a buněk imunitního systému [9] Vitámín D. Národní zdravotnický informační portál. Dostupné z: https://www.nzip.cz/clanek/1131-vitamin-d [cit. 2025 10 10]. .
Pozitivní vliv na pevnost kostí má cvičení se zátěží všech svalových skupin (tzv. weight bearing) alespoň 3× týdně, principem je zatížení kostí proti gravitaci, tím se zesilují a zahusťují. Z těsného vztahu mezi svalstvem a skeletem v dětském věku, který však částečně slábne po pubertě, je dovozován pozitivní vliv rozvoje svalstva na fyziologický stav kosti i v dosplém věku [10] Horák P, Skácelová M. Současné možnosti léčby postmenopauální osteoporózy. Klin Farmakol Farm 2014;28(3):99–104. Dostupné z: https://klinicka-farmakologie.cz/pdfs/far/2014/03/04.pdf. . Mediátorem pozitivního vlivu zátěže na kost je také IGF-1, který zvyšuje efekt fyzické zátěže na kost. Jedná se o peptidový hormon, strukturou podobný inzulinu a podporující růst a vývoj tkání, především svalů. Koncentrace IGF-1 je zvyšována fyzickou zátěží, a to již po 30 minutách intenzivního cvičení [11] Žofková I. Měkké tkáně a skelet. In: Osteologie a kalcium fosfátový metabolizmus. Praha: Grada Publishing, 2012:66–71. . Naopak nadměrná tělesná zátěž může vést k vážným poruchám skeletu. Tento stav je označován jako „ženská atletická triáda“ – poruchy příjmu potravy, amenorea a osteoporóza [12] Center JR, et al. Risk of subsequent fracture after low-trauma fracture in men and women. JAMA 2007;297(4):387–94. . Sekundární prevence osteoporózy je zaměřená na pacienty, u kterých již osteoporotická zlomenina proběhla. V případě, že zlomenina není rozpoznána jako osteoporotická a není zahájená adekvátní léčba, je pacient vystaven nadměrnému riziku následné zlomeniny 2- až 5násobně. Pro snížení počtu následných zlomenin byl navržen mezinárodní projekt koordinované sekundární prevence OP zlomenin, tzv. Fracture Liaison Services (FLS). V roce 2012 pak International Osteoporosis Foundation zaštítila projekt FLS pod názvem Capture the Fracture® [13] Akesson K, Marsh D, Mitchell PJ, et al. Capture the Fracture: a Best Practice Framework and global campaign to break the fragility fracture cycle. Osteoporos Int 2013;24(8):2135-52. .
V České republice je tento model převzat Národním screeningovým centrem, vznikl pilotní projekt Sekundární prevence osteoporotických zlomenin u osob nad 50 let věku po první prodělané OP zlomenině (OSTEO), pod záštitou odborné společnosti SMOS ČLS JEP, který ověřil realizovatelnost FLS programu v prostředí českého zdravotnického systému [14] Doporučený postup péče pro program sekundární prevence osteoporotických zlomenin. 2022. Dostupné z: https://nsc.uzis.cz/res/file/projekty/osteo/doporuceny-postup-pece-pro-program-sekundarni-prevence-osteoporotickych-zlomenin.pdf. , [15] Pikner R, et al. Fracture Liaison Services: Program koordinované sekundární prevence osteoporotických zlomenin. Clin Osteol 2021;26(3):119–32. Dostupné z: https://nsc.uzis.cz/res/file/projekty/osteo/pikner-2021-fracture-liaison-services-program-koordinovane-sekundarni-prevence-osteoporotickych-zlomenin.pdf. .
Terapie
Farmakologickou léčbu lze rozdělit na substituční, antiresorpční a osteoanabolickou. V klinické praxi se stále více uplatňuje sekvenční přístup.
Substituce spočívá v navýšení příjmu vápníku a vitaminu D, které jsou nezbytné pro správnou mineralizaci kostí. Vitamin D navíc podporuje vstřebávání vápníku ze střeva a reguluje hladiny vápníku a fosforu v krvi. Substituční terapie představuje první a základní pilíř každé léčby osteoporózy, na který navazují další specifické lékové skupiny. Doporučená denní dávka (DDD) vápníku je 1000 mg, v případě vitaminu D není DDD i vzhledem k částečně vlastní produkci přesně stanovena, nicméně bývá doporučováno přijmout alespoň 20 µg denně. Za zmínku stojí i vitamin K2, který pomáhá odvádět vápník z krevního oběhu a ukládat ho do kostí. Cílem antiresorpční terapie je potlačení aktivity osteoklastů a zpomalení odbourávání kosti. Do této skupiny se řadí bisfosfonáty, monoklonální protilátka denosumab, hormonálně substituční léčba (HRT) a selektivní modulátory estrogenových receptorů (SERM). Další hlavní skupinou je osteoanabolická terapie, která stimuluje novotvorbu kosti prostřednictvím aktivace osteoblastů. Do této kategorie patří rekombinantní analog parathormonu teriparatid a romosozumab, což je monoklonální protilátka proti sklerostinu (terapie přehledně v tabulce 1).
HRT se používá zejména u žen v období perimenopauzy, kdy dochází k prudkému poklesu hladiny estrogenu. Estrogeny působí protektivně na kostní tkáň tím, že snižují resorpci kosti zprostředkovanou osteoklasty. Vzhledem k některým rizikům (tromboembolické příhody, zvýšení incidence kardiovaskulárních příhod, karcinomu prsu a endometria) se HRT používá spíše krátkodobě v průběhu 3–5 let, a zejména k ovlivnění postklimakterického syndromu [16] Writing Group for the PEPI. Effects of hormone therapy on bone mineral density: results from the postmenopausal estrogen/progestin interventions (PEPI) trial. JAMA 1996;276:1389–96. .
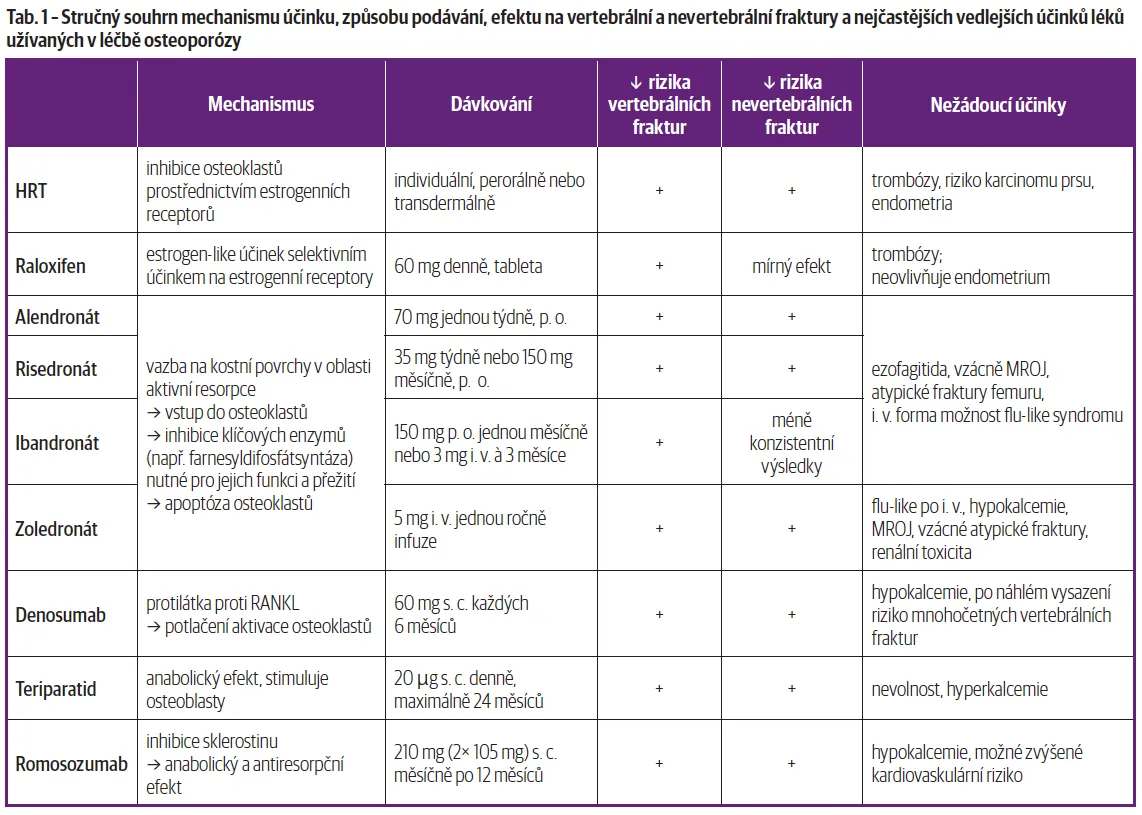
Raloxifen napodobuje účinek estrogenu na kostní tkáň, ale neovlivňuje prsní ani děložní tkáň. Snižuje kostní resorpci a riziko vertebrálních fraktur, avšak neprokazuje významný vliv na prevenci nevertebrálních zlomenin. Nevýhodou je zvýšené riziko žilní trombózy, v současnosti není v ČR komerčně dostupný [17] Delmas PD, Ensrud KE, Adachi JD, et al. Efficacy of raloxifene on vertebral fracture risk reduction in postmenopausal women with osteoporosis: four-year results from a randomized clinical trial. J Clin Endocrinol Metab 2002;87(8):3609–17. .
Alendronát je bisfosfonát, který inhibuje aktivitu osteoklastů a tím potlačuje kostní resorpci, zvyšuje kostní hustotu a snižuje riziko vertebrálních i nevertebrálních fraktur, včetně zlomenin kyčle. Podává se obvykle jednou týdně ve formě tablet. Je nutné dodržet specifický režim užívání – nalačno, zapít vodou a setrvat ve vzpřímené poloze alespoň 30 minut po požití, aby se předešlo podráždění jícnu. Hlavními nežádoucími účinky jsou gastrointestinální obtíže a velmi vzácně osteonekróza čelisti [18] Black DM, Cummings SR, Karpf DB, et al.; Fracture Intervention Trial Research Group. Randomised trial of effect of alendronate on risk of fracture in women with existing vertebral fractures. Lancet 1996;348(9041): 1535–41. , [19] Cummings SR, Black DM, Thompson DE, et al. Effect of alendronate on risk of fracture in women with low bone density but without vertebral fractures: results from the Fracture Intervention Trial. JAMA 1998;280(24):2077–82. .
Risedronát má podobný mechanismus účinku jako alendronát. Prokazatelně snižuje riziko jak vertebrálních, tak nevertebrálních fraktur. Výhodou je u části pacientů lepší gastrointestinální tolerance oproti alendronátu a kratší perzistence v kosti [20] Harris ST, Watts NB, Genant HK, et al.; VERT Study Group. Effects of risedronate treatment on vertebral and nonvertebral fractures in women with postmenopausal osteoporosis: a randomized controlled trial. JAMA 1999; 282(14):1344–52. . Ibandronát je užíván buď perorálně 1× měsíčně, nebo intravenózně (každé 3 měsíce), což zlepšuje adherenci k léčbě. Snižuje riziko zejména vertebrálních a podle metaanalýz i nevertebrálních fraktur. Mohou se vyskytnout gastrointestinální potíže nebo přechodné příznaky podobné chřipce po intravenózní aplikaci [21] Miller PD, McClung MR, Macovei L, et al. Monthly oral ibandronate therapy in postmenopausal osteoporosis: 1-year results from the MOBILE study. J Bone Miner Res 2005;20(8):1315–22. , [22] Chesnut CH, Skag A, Christiansen C, et al.; BONE Study Group. Effects of oral ibandronate administered daily or intermittently on fracture risk in postmenopausal osteoporosis. J Bone Miner Res 2004;19(8):1241–9. .
Zoledronát je silný bisfosfonát intravenózně podávaný v léčbě OP jednou ročně. Má výrazný efekt na snížení rizika vertebrálních, nevertebrálních i kyčelních zlomenin. Díky ročnímu podání zaručuje vysokou adherenci k léčbě, podání je nutné s dostatečnou hydratací a kontrolou ledvinných funkcí, po podání jsou poměrně časté chřipkové příznaky [23] Black DM, Delmas PD, Eastell R, et al.; HORIZON Pivotal Fracture Trial. Once-yearly zoledronic acid for treatment of postmenopausal osteoporosis. N Engl J Med 2007;356(18):1809–22. .
Denosumab je monoklonální protilátka, která inhibuje RANKL, klíčový faktor aktivace osteoklastů, a tím účinně potlačuje kostní resorpci. Podává se subkutánně jednou za 6 měsíců. Významně snižuje riziko vertebrálních, nevertebrálních i kyčelních zlomenin a účinek je reverzibilní po vysazení. Po ukončení terapie je nutné přejít na jiný antiresorpční lék, nejlépe intravenózní bisfosfonát, aby nedošlo k rychlému úbytku kostní hmoty a s tím spojenému riziku mnohočetných vertebrálních fraktur [24] Cummings SR, San Martin J, McClung MR, et al.; FREEDOM Trial. Denosumab for prevention of fractures in postmenopausal women with osteoporosis. N Engl J Med 2009;361(8):756–65. . Teriparatid je rekombinantní forma parathormonu, která podporuje kostní anabolismus stimulací syntézy kolagenu, uvolňováním IGF-I, stimuluje tvorbu nové kostní hmoty aktivací osteoblastů. Podává se denně formou subkutánní injekce po dobu 18–24 měsíců. Je indikován zejména u pacientů s těžkou osteoporózou, po prodělané OP fraktuře nebo při selhání jiných terapií. Je výhodným lékem v případě GIOP, kde je zejména snížená kostní novotvorba. Po ukončení léčby se doporučuje navázat antiresorpční terapií, aby se zisk nově vytvořené kosti stabilizoval [25] Neer RM, Arnaud CD, Zanchetta JR, et al. Effect of parathyroid hormone (1-34) on fractures and bone mineral density in postmenopausal women with osteoporosis. N Engl J Med 2001;344(19):1434–41. .
Romosozumab je monoklonální protilátka, která inhibuje sklerostin a tím současně stimuluje novotvorbu kosti i potlačuje její resorpci. Podává se subkutánně jednou měsíčně po dobu 12 měsíců. Klinické studie prokázaly významné snížení rizika vertebrálních a v sekvenčním režimu i nevertebrálních fraktur [26] Cosman F, Crittenden DB, Adachi JD, et al. Romosozumab treatment in postmenopausal women with osteoporosis. N Engl J Med 2016;375(16): 1532–43. , [27] Saag KG, Petersen J, Brandi ML, et al. Romosozumab or alendronate for fracture prevention in women with osteoporosis. N Engl J Med 2017;377(15): 1417–27. .
Sekvenční terapie
U většiny pacientů je nutná terapie trvající několik let, případně celoživotní. Je to dáno i tím, že věk sám o sobě je rizikovým faktorem pro vznik OP fraktury. Sekvenční terapie osteoporózy kombinuje výhody různých skupin léčiv s cílem maximalizace účinnosti. Právě pořadí a kombinace těchto léků mají zásadní vliv na účinnost terapie a výslednou hustotu kostní hmoty. Proto se v poslední době stále více porovnávají možné terapeutické strategie. Léčba bývá zahájena u velmi rizikových nemocných (po OP fraktuře) optimálně osteoanabolickým přípravkem, například teriparatidem či romosozumabem, jenž stimuluje tvorbu nové kosti. Po dosažení tohoto účinku je terapie převedena na antiresorpční léky, typicky bisfosfonáty nebo denosumab, které zabraňují nadměrnému odbourávání kosti a stabilizují nově vytvořenou kostní hmotu. Tento postup se ukázal být efektivnější než izolované podávání jednotlivých lékových skupin (Obr. 2).
Studie z roku 2009 hodnotila postmenopauzální ženy dlouhodobě léčené antiresorpční terapií alendronátem nebo raloxifenem. Výsledky ukázaly, že přidání teriparatidu ke stávající léčbě vedlo k většímu nárůstu BMD než jeho nasazení po vysazení antiresorpce. Nejvýraznější rozdíl se projevil v bederní páteři a kyčli. Přechod na samotný teriparatid sice vyvolal větší metabolickou aktivitu s vyšším vzestupem biochemických markerů kostního obratu, ale neprojevil se významným zvýšením hustoty kostí [28] Cosman F, Wermers RA, Recknor C, et al. Effects of teriparatide in postmenopausal women with osteoporosis on prior alendronate or raloxifene: differences between stopping and continuing the antiresorptive agent. J Clin Endocrinol Metab 2009;94(10):3772–80. . Podle studie z roku 2015 se ukázalo, že přechod z teriparatidu na denosumab vede k dalšímu nárůstu hustoty kostní hmoty, a to jak v páteři, tak v kyčli a krčku stehenní kosti. Naopak přechod z denosumabu na teriparatid vedl k úbytku kostní hmoty. Nejlepší výsledky přinesla kombinovaná léčba oběma přípravky, po níž následovalo podávání samotného denosumabu, což však v současnosti není léčba nemocným běžně hrazená z veřejného pojištění (Obr. 2) [29] Leder BZ, Tsai JN, Uihlein AV, et al. Denosumab and teriparatide transitions in postmenopausal osteoporosis (the DATA Switch study): extension of a randomised controlled trial. Lancet 2015;386:1147–55. .
Samotný přechod z antiresorpční léčby na teriparatid je spojen s nižším osteoanabolickým efektem. Na druhou stranu předléčení nemocných bisfosfonáty před nasazením denosumabu snižuje po jeho vysazení riziko rebound fenoménu.
Bezpečnost terapie
Většina současných léků má velmi příznivý poměr mezi účinností a riziky, přesto je nezbytné brát v úvahu možné nežádoucí účinky. Bisfosfonáty jsou obecně dobře snášeny, při perorálním podávání je kvůli možnému ohrožení jícnu potřeba dbát na správné užívání, po podání je nutné minimálně 30 minut si nelehat, nepředklánět se, nejíst a nepít, aby nedošlo k refluxu.
Při dlouhodobém užívání mohou být spojeny se vzácnými komplikacemi, jako je osteonekróza čelisti nebo atypické fraktury femuru. Léky indukovaná osteonekróza čelisti (MROJ) vzniká nejčastěji po invazivních stomatochirurgických výkonech a při špatném stavu hygieny dutiny ústní. K vzácným komplikacím patří atypické fraktury femuru, popisované především u dlouhodobé léčby bisfosfonáty i denosumabem [30] Garton M. Atypical femur fracture risk versus fragility fracture prevention with bisphosphonates. N Engl J Med 2020;383(22):2189. . Specifickým problémem spojeným s náhlým ukončením léčby denosumabem je rebound fenomén – prudká reaktivace kostní resorpce, vedoucí k mnohočetným vertebrálním frakturám během několika měsíců po vysazení [31] Cummings SR, Ferrari S, Eastell R, et al. Vertebral fractures after discontinuation of denosumab: a post hoc analysis of the randomized placebo controlled FREEDOM trial and its extension. J Bone Miner Res 2018;33(2):190–8. . Tento fenomén vyžaduje navazující léčbu, obvykle intravenózním bisfosfonátem [32] Everts Graber J, Reichenbach S, Gahl B, et al. Risk factors for vertebral fractures and bone loss after denosumab discontinuation: a real world observational study. Bone 2021;144:115830. .
Anabolická léčba teriparatidem či romosozumabem s duálním efektem je obvykle bezpečná, ale je indikována jen po omezenou dobu a u vybraných pacientů. Má však také svá úskalí – kontraindikována je u pacientů s těžkou poruchou funkce ledvin, chozí radioterapií, malignitami skeletu nebo kostními metastázami; romosozumab může zvyšovat kardiovaskulární riziko.
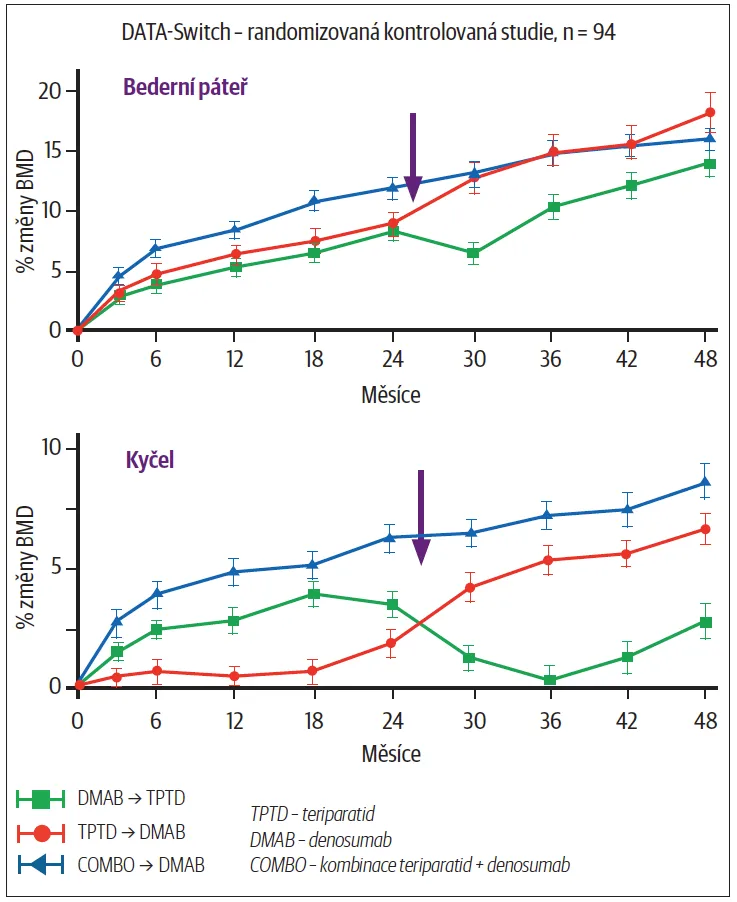
Obr. 2 – Sekvenční terapie. Přechod z teriparatidu na denosumab (červená) nebo z kombinované léčby na denosumab (modrá) vedl k dalšímu nárůstu BMD. Přechod z denosumabu na teriparatid (zelená) způsobil krátkodobý úbytek BMD v páteři a kyčli a postupný úbytek v oblasti předloktí. Kombinovaná terapie denosumabem a teriparatidem následovaná samotným denosumabem (modrá) vede k největším čtyřletým přírůstkům BMD v oblasti kyčle a zápěstí. Volba počáteční i následné léčby postmenopauzálních pacientek s osteoporózou by měla být zohledněna zejména při sekvenčním použití osteoanabolického přípravku (teriparatid) a silného antiresorpčního přípravku (denosumab). [Upraveno podle: 29]
Závěr
Osteoporóza zůstává navzdory rozsáhlým poznatkům o etiologii a patogenezi jedním z nejvýznamnějších zdravotních problémů současnosti. Dokážeme ji spolehlivě diagnostikovat, známe rizikové faktory i nejvíce ohrožené populační skupiny a máme k dispozici efektivní možnosti prevence. Farmakoterapie osteoporózy se v posledních letech významně rozšířila – disponujeme širokým spektrem účinných léků, které lze volit individuálně i sekvenčně podle klinické situace pacienta, a jejich účinnost na snížení rizika fraktur je dobře prokázána.
Na druhé straně však přetrvávají závažné nedostatky v implementaci těchto poznatků do klinické praxe i do primární a sekundární prevence. Nízká míra zachycení a léčby pacientů po osteoporotických zlomeninách, nedostatečná adherence k dlouhodobé terapii a omezené povědomí veřejnosti o možnostech prevence představují klíčové bariéry v boji s tímto onemocněním. V současnosti se ale díky edukaci odborné i široké veřejnosti situace postupně zlepšuje.
Literatura
Kompletní seznam odborných zdrojů a vědeckých publikací použitých v této práci
1. Anis JA, Melton LJ, Christiansen C, et al. The diagnosis of osteoporosis. J Bone Miner Res 1994;9(8):1137–41.
2. Svedbom A, et al. Osteoporosis in the European Union: a compendium of country-specific reports. Arch Osteoporos 2013;8(1):137.
3. Kanis JA, Norton N, Harvey NC, et al. SCOPE 2021: a new scorecard for osteoporosis in Europe. Arch Osteoporos 2021;16(1):82.
4. Němec P, Bučková B, Hejduk K, et al. Sekundární prevence osteoporotických zlomenin u stárnoucí populace mužů a žen v České republice. Gynekol Porod 2019;3(1):15–20.
5. van Staa TP, Leufkens HG, Abenhaim L, et al. Use of oral corticosteroids and risk of fractures. J Bone Miner Res 2000;15:993–1000.
6. Barron RL, Oster G, Grauer A, et al. Determinants of imminent fracture risk in postmenopausal women with osteoporosis. Osteoporos Int 2020;31(11): 2103–10.
7. Delmas PD, Genant HK, Crans JL, et al. Severity of prevalent vertebral fractures and the risk of subsequent vertebral and nonvertebral fractures: results from the MORE trial. Bone 2003;33(4):522–32.
8. Vápník. Národní zdravotnický informační portál. Dostupné z: https://www.nzip.cz/clanek/1146-vapnik [cit. 2025 10 10].
9. Vitamín D. Národní zdravotnický informační portál. Dostupné z: https://www.nzip.cz/clanek/1131-vitamin-d [cit. 2025 10 10].
10. Horák P, Skácelová M. Současné možnosti léčby postmenopauzální osteoporózy. Klin Farmakol Farm 2014;28(3):99–104. Dostupné z: https://klinicka-farmakologie.cz/pdfs/far/2014/03/04.pdf.
11. Žofková I. Měkké tkáně a skelet. In: Osteologie a kalcium fosfátový metabolizmus. Praha: Grada Publishing, 2012:66–71.
12. Center JR, et al. Risk of subsequent fracture after low-trauma fracture in men and women. JAMA 2007;297(4):387–94.
13. Akesson K, Marsh D, Mitchell PJ, et al. Capture the Fracture: a Best Practice Framework and global campaign to break the fragility fracture cycle. Osteoporos Int 2013;24(8):2135-52.
14. Doporučený postup péče pro program sekundární prevence osteoporotických zlomenin. 2022. Dostupné z: https://nsc.uzis.cz/res/file/projekty/osteo/doporuceny-postup-pece-pro-program-sekundarni-prevence-osteoporotickych-zlomenin.pdf.
15. Pikner R, et al. Fracture Liaison Services: Program koordinované sekundární prevence osteoporotických zlomenin. Clin Osteol 2021;26(3):119–32. Dostupné z: https://nsc.uzis.cz/res/file/projekty/osteo/pikner-2021-fracture-liaison-services-program-koordinovane-sekundarni-prevence-osteoporotickych-zlomenin.pdf.
16. Writing Group for the PEPI. Effects of hormone therapy on bone mineral density: results from the postmenopausal estrogen/progestin interventions (PEPI) trial. JAMA 1996;276:1389–96.
17. Delmas PD, Ensrud KE, Adachi JD, et al. Efficacy of raloxifene on vertebral fracture risk reduction in postmenopausal women with osteoporosis: four-year results from a randomized clinical trial. J Clin Endocrinol Metab 2002;87(8):3609–17.
18. Black DM, Cummings SR, Karpf DB, et al.; Fracture Intervention Trial Research Group. Randomised trial of effect of alendronate on risk of fracture in women with existing vertebral fractures. Lancet 1996;348(9041): 1535–41.
19. Cummings SR, Black DM, Thompson DE, et al. Effect of alendronate on risk of fracture in women with low bone density but without vertebral fractures: results from the Fracture Intervention Trial. JAMA 1998;280(24):2077–82.
20. Harris ST, Watts NB, Genant HK, et al.; VERT Study Group. Effects of risedronate treatment on vertebral and nonvertebral fractures in women with postmenopausal osteoporosis: a randomized controlled trial. JAMA 1999; 282(14):1344–52.
21. Miller PD, McClung MR, Macovei L, et al. Monthly oral ibandronate therapy in postmenopausal osteoporosis: 1-year results from the MOBILE study. J Bone Miner Res 2005;20(8):1315–22.
22. Chesnut CH, Skag A, Christiansen C, et al.; BONE Study Group. Effects of oral ibandronate administered daily or intermittently on fracture risk in postmenopausal osteoporosis. J Bone Miner Res 2004;19(8):1241–9.
23. Black DM, Delmas PD, Eastell R, et al.; HORIZON Pivotal Fracture Trial. Once-yearly zoledronic acid for treatment of postmenopausal osteoporosis. N Engl J Med 2007;356(18):1809–22.
24. Cummings SR, San Martin J, McClung MR, et al.; FREEDOM Trial. Denosumab for prevention of fractures in postmenopausal women with osteoporosis. N Engl J Med 2009;361(8):756–65.
25. Neer RM, Arnaud CD, Zanchetta JR, et al. Effect of parathyroid hormone (1-34) on fractures and bone mineral density in postmenopausal women with osteoporosis. N Engl J Med 2001;344(19):1434–41.
26. Cosman F, Crittenden DB, Adachi JD, et al. Romosozumab treatment in postmenopausal women with osteoporosis. N Engl J Med 2016;375(16): 1532–43.
27. Saag KG, Petersen J, Brandi ML, et al. Romosozumab or alendronate for fracture prevention in women with osteoporosis. N Engl J Med 2017;377(15): 1417–27.
28. Cosman F, Wermers RA, Recknor C, et al. Effects of teriparatide in postmenopausal women with osteoporosis on prior alendronate or raloxifene: differences between stopping and continuing the antiresorptive agent. J Clin Endocrinol Metab 2009;94(10):3772–80.
29. Leder BZ, Tsai JN, Uihlein AV, et al. Denosumab and teriparatide transitions in postmenopausal osteoporosis (the DATA Switch study): extension of a randomised controlled trial. Lancet 2015;386:1147–55.
30. Garton M. Atypical femur fracture risk versus fragility fracture prevention with bisphosphonates. N Engl J Med 2020;383(22):2189.
31. Cummings SR, Ferrari S, Eastell R, et al. Vertebral fractures after discontinuation of denosumab: a post hoc analysis of the randomized placebo controlled FREEDOM trial and its extension. J Bone Miner Res 2018;33(2):190–8.
32. Everts Graber J, Reichenbach S, Gahl B, et al. Risk factors for vertebral fractures and bone loss after denosumab discontinuation: a real world observational study. Bone 2021;144:115830.
Souhrn literatury
Kompletní seznam 32 odborných zdrojů zahrnuje klíčové studie a guidelines v oblasti osteoporózy